摘要:研究针对胆管癌患者对多重酪氨酸激酶抑制剂苏法替尼耐药的关键机制。
胆管癌是一种起源于胆管上皮的高度恶性肿瘤,因其发病隐匿、进展迅速且治疗手段有限,患者预后极差。尽管手术切除是目前唯一可能治愈的方法,但多数患者确诊时已失去手术机会。传统化疗方案如吉西他滨联合顺铂,虽然是一线标准治疗,但疗效有限,患者中位生存期难以令人满意。近年来,靶向治疗为胆管癌患者带来了新的希望,特别是多重酪氨酸激酶抑制剂(mTKI)如苏法替尼(surufatinib)在临床应用中显示出一定的潜力。然而,与许多靶向药物一样,耐药性问题日益凸显,相当一部分患者对mTKI治疗无应答或很快产生耐药,这成为临床实践中的主要挑战。
深入研究胆管癌靶向治疗耐药机制,对于提高治疗效果、延长患者生存期具有重要意义。以往研究多关注于肿瘤细胞内在的基因突变或表观遗传改变,而对肿瘤微环境在耐药中的作用关注相对不足。尤其值得注意的是,胰岛素样生长因子1受体(IGF1R)信号通路在多种肿瘤中被证实参与耐药形成,但在胆管癌中的具体作用机制尚不明确。同时,蛋白质酪氨酸磷酸酶(PTP)家族作为酪氨酸激酶的天然负调控因子,其在调节受体酪氨酸激酶(RTK)活性中的作用也值得深入探讨。
 图1 PTPN9通过去磷酸化IGF1RY1165/1166位点,缓解胰岛素样生长因子1受体介导的胆管癌对酪氨酸激酶抑制剂的耐药性
图1 PTPN9通过去磷酸化IGF1RY1165/1166位点,缓解胰岛素样生长因子1受体介导的胆管癌对酪氨酸激酶抑制剂的耐药性发表在《Journal of Experimental & Clinical Cancer Research》上的这项研究,由山东大学齐鲁医院普通外科张志利教授团队完成,系统阐述了PTPN9-IGF1R信号轴在胆管癌mTKI耐药中的关键作用。研究人员通过临床样本分析、分子生物学实验和动物模型验证,揭示了肿瘤微环境中癌症相关成纤维细胞(CAF)来源的IGF1通过激活IGF1R,进而导致对苏法替尼的耐药;而PTPN9作为重要的负调控因子,能够逆转这一过程。
为开展此项研究,研究人员采用了多项关键技术方法:利用免疫沉淀联合质谱分析(IP-MS)筛选PTPN9的作用底物;通过晶体结构解析明确PTPN9与IGF1R的相互作用机制;建立正交小鼠模型进行体内药效验证;采用单细胞RNA测序技术分析肿瘤微环境中IGF1的来源;并通过组织微阵列(TMA)和免疫组化分析临床样本中PTPN9和IGF1R的表达与患者预后的关系。临床样本来源于山东大学齐鲁医院收治的胆管癌患者。
PTPN9-IGF1R介导TKI耐药在胆管癌中的作用
研究人员首先比较了苏法替尼应答与非应答胆管癌患者肿瘤组织中PTPN9的表达差异,发现非应答组PTPN9表达显著降低,提示PTPN9可能与苏法替尼耐药相关。通过建立正交胆管癌小鼠模型,证实PTPN9过表达增强了对苏法替尼的敏感性,而敲低PTPN9则导致耐药。
进一步的机制探索中,研究人员通过IP-MS技术筛选出IGF1R是PTPN9的潜在新底物。TCGA数据库分析显示IGF1R在胆管癌组织中显著高表达。体外实验证实PTPN9与IGG1R存在直接相互作用,且在苏法替尼应答患者组织中,PTPN9与IGF1R有明显的共定位,而非应答组织中这种共定位显著减少。
PTPN9相互作用并去磷酸化IGF1RY1165/1166在胆管癌中
生物信息学分析显示,IGF1R磷酸化位点Y1165/1166周围序列与已知的PTPN9底物(如TrkAY674/675和FGFR2Y656/657)具有高度同源性。酶动力学实验证实了PTPN9与p-IGF1RY1165/1166之间的酶-底物关系。
功能实验表明,敲低PTPN9增强了IGF1刺激的IGF1RY1165/1166磷酸化,促进细胞增殖、迁移和侵袭;而过表达PTPN9则产生相反效果。IGF1R的激活突变(Y1165/1166E)增强而失活突变(Y1165/1166F)减弱了这些恶性表型。动物实验进一步证实,IGF1促进而IGF1R抑制剂林西替尼(linsitinib)抑制了肿瘤生长。
IGF1R旁路激活促进胆管癌中TKI耐药
临床样本分析显示,IGF1R在胆管癌组织中高表达,且与患者不良预后相关。通过逐步剂量递增法建立的苏法替尼耐药细胞株(QBC-939/SR)显示出对苏法替尼的耐受性增强,同时伴有IGF1RY1165/1166磷酸化水平升高以及下游PI3K-Akt和MEK-Erk通路激活。
体内实验表明,苏法替尼与林西替尼联合应用显著抑制了肿瘤生长,效果优于单药治疗。IGF1R过表达或Y1165/1166激活突变减弱了苏法替尼的抑瘤效果,而失活突变则增强了药物敏感性,证实IGF1R磷酸化状态是决定TKI敏感性的关键因素。
PTPN9识别和去磷酸化IGF1RY1165/1166的结构基础
通过X射线晶体学分析,研究人员解析了PTPN9与p-IGF1RY1165/1166短肽复合物的晶体结构,分辨率达2.0埃。结构分析显示,p-Y1166深入PTPN9催化中心,引起WPD环向内移动6.7埃,β3-β4环向外移动2.5埃,这些构象变化对酶活性至关重要。
Tyr333和Asp335是PTPN9-IGF1R相互作用的关键位点
酶动力学分析显示,PTPN9对p-IGF1RY1165/1166具有较高的催化效率,尤其偏好Y1166位点。点突变实验证实,Tyr333和Asp335是维持PTPN9催化活性的关键残基,它们的突变显著降低了酶活性。功能实验表明,这些关键位点的突变削弱了PTPN9对IGF1R信号通路的负调控作用。
CAF来源的IGF1激活IGF1R并促进胆管癌进展
单细胞RNA测序分析显示,成纤维细胞是肿瘤微环境中IGF1的主要来源。通过分离原代癌症相关成纤维细胞(CAF)并检测其条件培养基,证实CAF分泌高水平的IGF1。功能实验表明,CAF条件培养基促进肿瘤细胞增殖、迁移和侵袭,而这一效应可被IGF1中和抗体或IGF1R敲低所逆转。
动物实验进一步验证,与CAF共注射显著促进肿瘤生长,而CAF中IGF1敲低或使用IGF1中和抗体则抑制肿瘤发展。IGF1R敲低的肿瘤细胞对CAF条件培养基的促瘤作用不敏感,而过表达IGF1R则增强这一效应。
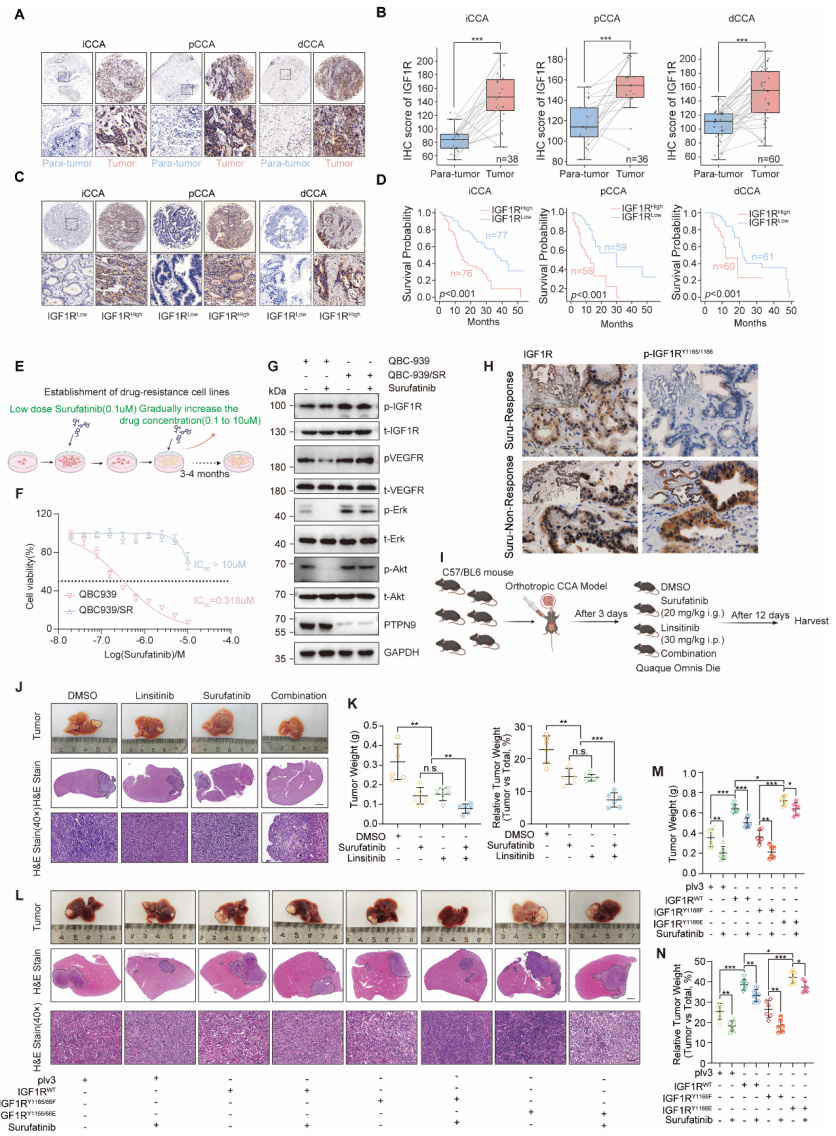 图2 PTPN9-IGF1R介导TKI耐药在胆管癌中的作用
图2 PTPN9-IGF1R介导TKI耐药在胆管癌中的作用讨论与结论
本研究系统阐明了CAF来源的IGF1/PTPN9-IGF1R信号轴在胆管癌进展和TKI耐药中的核心作用。研究发现不仅揭示了IGF1R作为胆管癌不良预后因子的临床意义,还首次明确了PTPN9作为IGF1R磷酸酶的功能及其在调节TKI敏感性中的关键作用。
从机制角度看,本研究有多项重要发现:首先,通过结构生物学手段精确解析了PTPN9与IGF1R相互作用的分子基础,鉴定出Tyr333和Asp335是关键催化残基;其次,利用单细胞技术明确了CAF是肿瘤微环境中IGF1的主要来源,深化了对肿瘤-基质相互作用的理解;第三,通过体内外实验证实了PTPN9下调是导致IGF1R信号异常激活的重要原因;最后,治疗学实验证明联合应用IGF1R抑制剂林西替尼可有效逆转苏法替尼耐药。
这些发现对胆管癌临床实践具有重要指导意义:一方面,PTPN9表达和IGF1R磷酸化状态可作为预测mTKI疗效的生物标志物,实现治疗前患者分层;另一方面,苏法替尼与林西替尼的联合使用策略为克服耐药提供了新思路。考虑到林西替尼已在早期临床试验中显示出可管理的安全性,这一联合方案具有较好的临床转化前景。
值得注意的是,本研究也存在一定局限性,如仅使用单一耐药细胞系可能无法涵盖所有耐药机制,以及林西替尼对胰岛素受体(IR)的抑制可能带来代谢副作用等。未来研究可探索新一代IGF1R选择性降解剂,以提高靶向特异性并改善安全性。
总体而言,这项研究深化了对胆管癌靶向治疗耐药机制的理解,提出了基于生物标志物的精准治疗策略,为改善胆管癌患者预后提供了新的思路和方法。通过同时靶向肿瘤细胞内在信号和微环境调控,有望实现更有效、更持久的治疗效果。
参考资料
[1] PTPN9 dephosphorylates IGF1RY1165/1166 and alleviates IGF1R-mediated resistance to tyrosine kinase inhibitor in cholangiocarcinoma