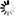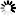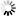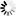BRAF致癌突变通过αC螺旋位移解除自抑制的共通机制解析
 图1 BRAF致癌突变体通过共同机制规避自身抑制
图1 BRAF致癌突变体通过共同机制规避自身抑制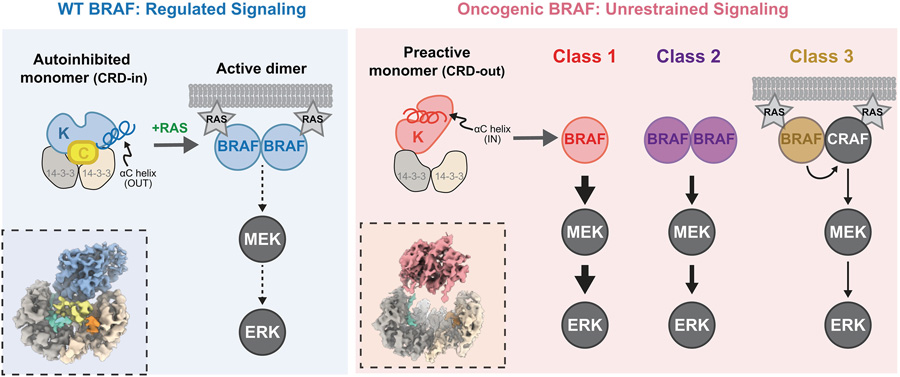
图2 通过冷冻电镜(Cryo-EM)对致癌性BRAF变体(红色阴影标注)与野生型BRAF(蓝色阴影标注)进行结构分析,揭示了其活性失控的分子机制
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- Leukemia:基于CRISPR的基因疗法为白血病治疗带来希望
- 平台式三维划膜喷金仪 XYZ3020
- 膜蛋白提取去垢剂--十二烷基-β-D-麦芽糖苷
- NEJM:连续一年不吃晚餐,身体会有什么变化?
- 美国发现首例mcr-1多粘菌素耐药感染
- 以毒攻毒,病毒治脑癌!日本率先实现应用溶瘤病毒治疗恶性脑胶质瘤
- J Bio Chem:突破!绿茶、胡萝卜中的关键成分可以逆转阿尔兹海默症!
- 天冬酰胺转运体通过组蛋白磷酸化调控巨噬细胞炎症:炎症性疾病治疗新靶点
- 西宝生物《全员学习系统》商学院开院仪式
- 中国肿瘤免疫疗法低价时代来临?
新进产品
同类文章排行
- BRAF致癌突变通过αC螺旋位移解除自抑制的共通机制解析
- 靶向钙黏蛋白17(Cadherin-17/CDH17)的CAR-T细胞系统性递送策略:安全有效治疗结直肠癌肝转移的新突破
- 肿瘤微环境分析发现肺癌的治疗应答标志物
- 《Nature Neuroscience》大脑白质为何随年龄退化?因为免疫细胞“勾心斗角”
- 基于序列预测驱动无序区域介导的分子间相互作用
- 《Nature》NYU 研究揭示氨基酸限制对体重惊人影响
- Cell:生酮饮食会影响抗癌药物活性?最新研究指出肠道微生物组-膳食的相关癌症影响
- Nature Aging:中年人如何患上痴呆症?可能与这些蛋白质有关
- 饭后血糖如何控?透明质酸酶 -1的意外角色与糖尿病新希望
- Nature:牛磺酸能推动白血病癌细胞生长!
资讯文章
您的浏览历史