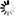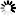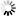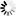FITC标记葡聚糖
化学名称:
·Dextran(3’,6’-dihyroxy-3-Oxospiro (isobenzofuran-1-(3H), 9'-[9Hxanthen]-5 (or 6)-ylcarbamothiate.
·Fluoresceinisothiocyanate-dextran
· Fluoresceinyl thiocarbamoyl-dextran
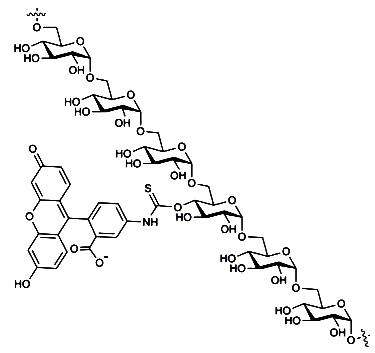
图1 FITC标记葡聚糖分子结构示意图
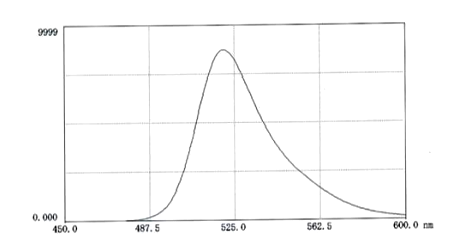
图2 FITC标记葡聚糖70在pH9.0磷酸盐缓冲生理盐水中的荧光图谱

图3 FITC标记葡聚糖在pH4-9的荧光(发射波长520nm)
|
Dextran MW
|
斯托克斯半径 (Å)
|
回转半径 (Å)
|
|
2 x 106
|
270
|
380
|
|
1 x 106
|
199
|
275
|
|
500 000
|
147
|
200
|
|
200 000
|
130
|
130
|
|
100 000
|
69
|
95
|
|
70 000
|
58
|
80
|
|
40 000
|
44.5
|
62
|
|
10 000
|
23.6
|
-
|

Fig. 4. 不同浓度下葡聚糖的粘度
|
产品编号
|
品名
|
分子量(kDa)
|
包装
|
|
FD4-100mg
|
FITC标记葡聚糖4
|
4
|
100 mg
|
|
FD4-1g
|
1 g
|
||
|
FD4-5g
|
5 g
|
||
|
FD10-100mg
|
FITC标记葡聚糖10
|
10
|
100 mg
|
|
FD10-1g
|
1 g
|
||
|
FD10-5g
|
5 g
|
||
|
FD20-100mg
|
FITC标记葡聚糖20
|
20
|
100 mg
|
|
FD20-1g
|
1 g
|
||
|
FD20-5g
|
5 g
|
||
|
FD40-100mg
|
FITC标记葡聚糖40
|
40
|
100 mg
|
|
FD40-1g
|
1 g
|
||
|
FD40-5g
|
5 g
|
||
|
FD70-100mg
|
FITC标记葡聚糖70
|
70
|
100 mg
|
|
FD70-1g
|
1 g
|
||
|
FD70-5g
|
5 g
|
||
|
FD110-100mg
|
FITC标记葡聚糖110
|
110
|
100 mg
|
|
FD110-1g
|
1 g
|
||
|
FD110-5g
|
5 g
|
||
|
FD150-100mg
|
FITC标记葡聚糖150
|
150
|
100 mg
|
|
FD150-1g
|
1 g
|
||
|
FD150-5g
|
5 g
|
||
|
FD500-100mg
|
FITC标记葡聚糖500
|
500
|
100 mg
|
|
FD500-1g
|
1 g
|
||
|
FD500-5g
|
5 g
|
||
|
FD2000-100mg
|
FITC标记葡聚糖2000
|
2000
|
100 mg
|
|
FD2000-1g
|
1 g
|
||
|
FD2000-5g
|
5 g
|

图5. 注射FITC标记葡聚糖 150后拍摄的颊囊图像。第二张图显示的是服用组胺后微血管的渗漏
(图片版权E. Svensjö)
2. N.Thorball. FITC-Dextran tracers in microcirculatory and permeability studies using combined fluorescence Stereo Microscopy, Fluorescence Stereo microscopy and electron microscopy. Histochemistry. 1981:71;209-233.
3. K.G.Ljungström, H.Rench, K.Strandberg et al. Adverse reactions to dextran in Sweden 1970-1979 Acta Chir Scan, 1983; 149:253-262
4. H.Hedin, W.Richter and J.Ring. Dextran-induced anaphylactoid reactions in man: role of dextran reactive antibodies Int. Arch Allergy Appl Immun. 1976; 52:145-159.
5. A.N de Belder and K.Granath. Preparation and properties of fluorescein labelled dextrans. Carbohydr Res. 1973;30:375-378.
6. M.J.Geisow, P.D’Arcy Hart and M.R.Young. Temporal changes of lysosome and phagosome pH during phagolysosome formation in macrophages; studies by fluorescence spectroscopy. J Cell Biol. 1981;89: 645-652.
7. S.Ohkuma and B.Poole. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH of by various agents. Proc Natl Acad Sci USA, 1978;75:3327-3331.
8. E.Svensjö, E.M Saraiva, M.T.Bozza, et al. Salivary gland homogenates of Lutzomyia longipalpis and its vasodilatory peptide maxadilan cause plasma leakage via PAC 1 receptor activation. J. Vasc Res. 2009;46:435-446.
9. E.Svensjö. The hamster cheek pouch as a model in microcirculation research. Eur Respir J Suppl 12. 1990; 595s-600s; discussion 600s-601s.
10. E.Svensjö. The hamster cheek pouch as a research model in inflammation. Chapter 30 in David Shepro (Editor), Microvascular Research-Biology and Pathology, p.195-207, 2006, Elsevier Academic Press.
11. J.Jonsson, K.E.Arfors and H.C.Hint. Studies on relationships between blood and lymphatic systems within the microcirculation. 6th Europ Conf Microcirculation, Aalborg. 170;214-218 (Karger; Basel 1971).
12. T.Mochizuki, H.Satsu, M.Totsuka and M.Shimizu. Transepithelial transport of macromolecular substances in IL-4 treated human intestinal T84 cell monolayers. Biosci Biotechnol Biochem. 2009;73:2422-6.
13. B.Lei, W.Zha, Y.Wang, et al. Development of a novel self-microemulsifying drug delivery system for reducing HIV protease inhibitor-induced intestinal epithelial barrier dysfunction. Mol Pharm. 2010; 7:844-53.
14. F.Bertiaume, R.M.Ezzell, M. Toner et al. Transport of fluorescent dextrans across the rat ileum after cutaneous thermal injury. Critical Care Medicine. 1994;22:455-64.
15. N.Pantzar, B.R.Weström, A.Luts and S.Lundin. Regional small-intestinal permeability in vitro to different-sized dextrans and proteins in the rat. Scand J Gastroenterol. 1993;28:205-11.
16. C.Tagesson, R.Sjödahl, B.Thorén, Passage of moleclues through the wall of the gastrointestinal tract.. A simple experimental model. Scand J Gastroente- rol. 1978;13:519-24.
17. D.Hultström. FITC-Dextrans in neurobiological research. Acta Universitatis Upsaliensis, 438, Almquist and Wiksell, Uppsala, 1982 and references cited therein.
18. Y.Olsson, E.Svensjö, K.E.Arfors. Fluorescein labelled dextrans as tracers for vascular permeability studies in the nervous system. Acta Neuropathol. 1975; 33:45-50.
19. W.Shougang, B.Baseri, J.Choi et al. Delivery of fluorescent dextrans through the ultra-sound induced blood-brain barrier opening in mice. Ultrasonics Symposium, 2008; IUS2008:1702-1705.
20. T.Ishi, T.Asai, T.Urakami et al. Accumulation of macromolecules in brain parenchyma in acute phase of cerebral infarction/reperfusion. Brain Res. 2010;19:164-8.
21. F.Chen, N.Ohashi, W.Li et al. Disruptions of occludin and claudin-5 in brain endothelial cells in vitro and in brains of mice with acute liver failure. Hepatology. 2009;50:1914-23.
22. L.E.Gerlowski and R.K.Jain. Microvascular permeability of normal and neoplastic tissues. Microvasc. Res. 1986; 31:288-305.
23. T.Li, Q.Hao, and X.Wang et al. The effect of focused ultrasound on the physiochemical properties of Sarcoma 180 cell membrane. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2009 Oct:26(5);941-6. Chinese
24. F.Chen, M.Hou, F.Ye et al. Ovarian cancer cellls induce peripheral mature dendritic cells to differentiate into macrophage-like cells in vitro. Int J Gynecol Cancer. 2009:19;1487-93.
25. E.Mannermaa, M.Reinisalo, V.P.Ranta et al. Filter cultured ARPE-10 cells as outer blood-retinal barrier model. Eur J Pharm Sci. 2010;40:289-296 .
26. M.Shivanna, G.Rajashekhar and S.P.Srinivas. Barrier dysfunction of the corneal endothelium in response to TNF alpha. Invest Ophtalmol Vis Sci. 2010;51:1575-82.
27. S.L.Lightman, L.E.Caspers-Velu, S.Hirose et al. Angiography with fluorescein-labelled dextran in a primate model of uveitis. Arch Ophthalmol. 1987:105;844-848.
28. M.Arare and D.M.Maurice. The loss of fluorescein, fluorescein glucuronide and fluorescein iso-thiocyanate dextran from the vitreous by the anterior and retinal pathways. Exp Eye Res. 1991:52;27-39.
29. C.B.Toris, D.S.Gregerson and J.E.Pederson. Uveoscleral outflow using different-sized fluorescent tracers in normal and inflamed eyes. Exp Eye Res. 1987:45;525-32.
30. R.D.Hamilton, A.J.Foss and L.Leach. Establishment of a human in vitro model of the outer blood-retinal brain barrier. J. Anat. 2007;211:707-16.
31. W. I. Lencer, P.Weyer, A.S. Verkman et al. FITC-Dextran as a probe for endosome fuction and localization in kidney. Amer J Physiol. 1990:258;C309-317.
32. N.Uchida, Y.Maitani Y.Machida et al. Influence of bile salts on the permeability of insulin through the nasal mucosa of rabbits in comparison with dextran derivatives. Int J Pharm. 1991:74;95-104.
33. K.Fukushima, A.Isa, H.Morita et al. Two-layered dissolving microneedles for percutaneous delivery of peptide/protein drus in rats. Pharm Res. 2010 (E-pub ahead of print).
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- 《Nature》发布COVID-19病毒复制的关键机制
- 氢化卵磷脂功效及应用场景
- 乙肝疫苗疑致死事件 谁之过?
- 生物质高分子材料应用和发展趋势
- PNAS:万万没想到,结核杆菌自己提供促进空气传播的基因
- 【产品推荐】链霉亲和素(Streptavidin,SA)
- 《Nature Biotechnology》新技术增强了对染色质组织的认识
- 符合国标GB 3838-2002的地表水检测有机物标准品与混标
- Nature:科学家有望开发出抵御诸如呼吸道合胞病毒等诱发肺炎的病毒的新型疗法
- 蓝色葡聚糖BLUE-dextran
新进产品
同类文章排行
- 汽巴蓝3G-A(Cibacron Blue 3G-A)
- 异硫氰酸荧光素 (FITC)
- TdB染料
- 透明质酸衍生物 Hyaluronic acid derivatives
- 聚蔗糖 Polysucrose
- 季胺标记葡聚糖 Q-Dextran
- 苯基标记葡聚糖 Phenyl-dextran
- 赖氨酸标记葡聚糖 Lysine-Dextran
- 羧甲基标记聚蔗糖 CM-Polysucrose
- 羧甲基标记葡聚糖 CM-Dextran
资讯文章
您的浏览历史